-
為(wei) 更好地提高納米金殼材料對惡性腫瘤的抑製率,同時針對目前近紅外光熱治療癌症技術中照射時間長、照射強度大、需重複多次照射等問題,中科院理化技術研究所納米材料可控製備與(yu) 應用研究室在研究員唐芳瓊的帶領下,進一步發展了納米金殼偶聯主動靶向配體(ti) 分子轉鐵蛋白新技術。最新研究進展在國際材料界頂級刊物《先進材料》上發表。
實現惡性腫瘤的安全有效治療是目前生物醫學界的重大挑戰之一。唐芳瓊研究室近年來一直致力於(yu) 設計發展新型納米載體(ti) 及其生物醫學應用。其中,具有新結構和新性能的多功能納米金殼是該團隊一直致力發展的新型抗腫瘤納米材料之一。該材料內(nei) 層以結構獨特的中空介孔夾心二氧化矽為(wei) 核,其表麵包覆金殼,納米金殼以其物理化學性質——等離子體(ti) 共振性質為(wei) 基礎,經近紅外激光照射,可將近紅外激光光能轉化為(wei) 熱能,並配以夾心二氧化矽對多種化療藥物的裝載控製緩釋技術,高效低毒殺死腫瘤細胞。
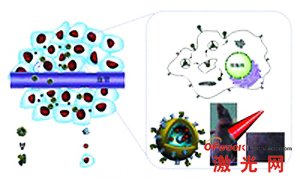
圖為(wei) 納米金殼偶聯轉鐵蛋白分子攜帶藥物靶向至腫瘤,
光熱療與(yu) 化療結合殺死腫瘤細胞
此次研發的納米金殼偶聯主動靶向配體(ti) 分子轉鐵蛋白新技術,納米金殼經偶聯靶向分子後,可在減少照射時間與(yu) 頻率、降低照射強度的條件下實現惡性腫瘤的有效抑製。荷乳腺癌裸鼠腫瘤模型注射該材料後,經單次近紅外激光照射即可消除腫瘤。在這一新的研究進展中,研究人員還首次係統對比研究了該新型多功能納米金殼偶聯主動靶向配體(ti) 分子前後生物體(ti) 內(nei) 安全性和代謝情況,結果表明該材料生物相容性良好,並可從(cong) 體(ti) 內(nei) 代謝。
轉載請注明出處。







 相關文章
相關文章
 熱門資訊
熱門資訊
 精彩導讀
精彩導讀
































 關注我們
關注我們

