流式細胞術是生物醫學科學中一項的基礎技術,這個(ge) 技術是使用激光來激發附著於(yu) 細胞的分子熒光標記,並用光電倍增管(PMT)和其他光感測技術對其探測(見圖一),將細胞以流體(ti) 動力聚集的液體(ti) 流的方式引入激光束。
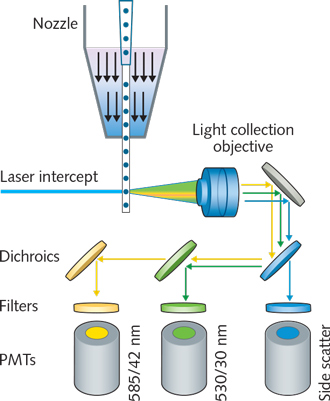
圖一。解析圖顯示基本流體(ti) 細胞術的運作方式,通過流體(ti) 動力聚焦,將細胞通過管口或封閉石英流動池引入液體(ti) 流中的激光束。采集信號的光學元件負責采集被激發的熒光信號,然後這些信號會(hui) 通過分色鏡和窄帶通濾波器導入光電倍增管。現代的儀(yi) 器可以把光纖用於(yu) 激光傳(chuan) 輸和信號收集。
一些流體(ti) 細胞儀(yi) 隻能分析那些附在細胞表麵或者在細胞內(nei) 部的熒光標記。 在熒光 一 激活細胞分類器中(FACS),液體(ti) 流分裂成液滴然後液滴產(chan) 生靜電荷然後轉移到收集管裏。細胞分選使基於(yu) 熒光標記的細胞能分離和被收集,能使被收集的細胞可以用於(yu) 功能研究和蛋白質組學和基因組分析。
激光應用在流式細胞術的背景
流式細胞術依靠激光技術來激發熒光標記是毫無疑問的1,最早的流體(ti) 細胞儀(yi) 采用單束激光器(當時通常為(wei) 大型水冷離子激光器)來激發最多一到兩(liang) 個(ge) 熒光探針,其中包括像熒光黃和若丹明的熒光素。當下的流體(ti) 細胞儀(yi) 采用波長從(cong) 紫外線(大約355nm)到長紅外線(大約700nm)橫跨整個(ge) 可見光譜的固體(ti) 激光器。
高級流式細胞儀(yi) 可以裝備多大十個(ge) 不同的單波長激光器,使很多種類的有著不同激發/發射特性的熒光探針能夠被激發。早期的儀(yi) 器隻能激發和探測一到兩(liang) 個(ge) 探針,而現在在高端的儀(yi) 器上,同時偵(zhen) 測三十個(ge) 甚至更多的熒光探針都已經成為(wei) 可能,這個(ge) 高維分析已經把我們(men) 對免疫係統的認知擴大到了前所未有的程度。
當前的流式細胞儀(yi) 用許多激光波長和相對應的熒光探針對二十個(ge) 或以上的細胞特征進行同步分析,這些先進的儀(yi) 器通常會(hui) 裝備一個(ge) 氰激光器(488nm)、一個(ge) 紅激光二極管(約640nm)、和一個(ge) 綠、綠黃、或黃色二極管泵浦固體(ti) 激光器(532/552/561nm),這些激光器都可以激發多種熒光素(見圖二)。

圖二:一個(ge) 在流式細胞術中與(yu) 能達到激發要求的激光波長配對的熒光探針的樣本。這些探針絕大多數都在光譜上兼容而且可以同時與(yu) 足夠多的激光波長使用在儀(yi) 器上。(BB:亮藍、BYG:亮黃綠、BV:亮紫、和BUV:亮紫外線染料是BD Sirigen的注冊(ce) 商標,而Pacific Blue,Alexa Fluor 647和Alexa Fluor 790是Thermo Fisher公司的注冊(ce) 商標。)
隨著BD Sirigen的亮紫(BV)聚合物染料的發展,紫色激光二極管成為(wei) 了重要的激發手段2。可以使用七種BV染料(BV421,BV480,BV570,BV605,BV650和BV787)進行光譜兼容、顯著增加可分析的同步細胞標記的數量。紫外線(UV)激光器在流式細胞儀(yi) 中已經越來越重要,最近開發的六種亮光紫外線染料(BUV395,VUV496,BUV563,BUV661,BUV737和BUV805),將同步熒光分析的總數接近30。目前,紫外激光已經成為(wei) 了高級流式細胞術儀(yi) 器使用中的一個(ge) 關(guan) 鍵部分。
當前的流式細胞儀(yi) 主要依靠三倍頻率摻雜釹的釩酸鹽(Nd:YVO4)355 nm固體(ti) 激光器來激發BUV和其他紫外線激發染料,這些激光器相對於(yu) 以前需要提供UV激發的氬離子和氪離子激光器而言是相當大的進步,因為(wei) 它們(men) 體(ti) 積更小並且更容易維護。然而,這些激光器還是很昂貴的,而且是高端儀(yi) 器中成本最高的單個(ge) 部件。
許多UV激發染料(包括BUV)可以代替355納米的較低成本的近紫外激光二極管(375nm)3。 然而,它們(men) 的波長非常接近BUV395的發射範圍,這是係列中最短的,使其難以檢測。 因此,需要相對便宜的固態紫外激光來降低高維流式細胞儀(yi) 的成本。
簡潔型320 nm激光模組
但是隨著近來在由LASOS(德國)開發的在小型風冷組件中連續波(CW)發射的小型固體(ti) 320nm激光模組的發展,情況已經改變了。流式細胞儀(yi) 在過去曾被裝備過氦鎘激光器,利用其325nm的激光線來激發紫外染料。 然而,氦鎘激光器不僅(jin) 體(ti) 積龐大,而且功率還不夠,另外時間長了還會(hui) 產(chan) 生噪聲。320nm光源的波長與(yu) 傳(chuan) 統的325nm波長非常接近,並且從(cong) 激發光譜的角度來看,應該能相當不錯地激發BUV染料。
為(wei) 了測試不論激光波長或光源是否適合應用在流式細胞術上,一個(ge) 320nm激光模組代替傳(chuan) 統325nm紫外激光安裝在了一個(ge) BD LSR II流式細胞儀(yi) 上(見圖三)4,然後將激光對準用於(yu) 將細胞注入激光路徑的液體(ti) 流。最初配置為(wei) 355 nm激光源的儀(yi) 器的光學元件保持有效範圍低至320 nm,寬帶UV鏡用於(yu) 將激光轉向樣本流和熔融石英透鏡以聚焦光束。
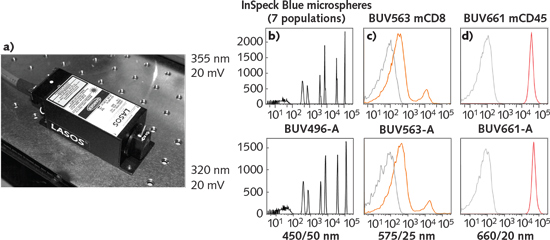
圖3. LASOS 320 nm激光模組非常簡介(a)。 用20mW的320(最高)或355nm(最低)激光源分析InSpeck Blue(b)微球混合物(7個(ge) 群體(ti) )。 以20mW的320(最高)或355nm(最低)激光源分析用BUV563或BUV661標記的小鼠脾細胞(c和d)。 彩色痕跡表示標記的細胞,而灰色跡線表示未標記的對照。 用於(yu) InSpeck Blue微球BUV463和BUV661標記細胞的帶通濾光片的光譜曲線顯示在直方圖下。 (圖片由William Telford提供)
流式細胞術使用熒光染料標記的聚合物微球作為(wei) 模擬樣本,以確定儀(yi) 器操作是否最佳,並測試新的激光源。 還分析了明亮和暗淡的紫外線激發微球(InSpeck Blue microspheres; Thermo Fisher,Eugene,OR)的混合物 - 最暗淡的群體(ti) 的分辨率是良好的激發和檢測的指標。 這些微球,包括最小的群體(ti) ,可以很容易地用圖3b激光源解決(jue) 。 靈敏度與(yu) 相同功率水平的355nm激光器相似。 然後使用與(yu) BUV563和BUV661(兩(liang) 種BUV染料)偶聯的抗體(ti) 將小鼠脾細胞標記為(wei) 細胞表麵標誌物。 320nm模組激發這些樣品幾乎與(yu) 355nm的激光源效果一樣(參見圖3c和3d)。
因此,這證明了LASOS 320nm激光源能在流式細胞術中良好地替代355nm激光源激發。 這些激光模組比大多數355 nm光源更小,成本更低,使其成為(wei) 高維流式細胞術有效的低成本替代品。 在這個(ge) 範圍內(nei) 和整個(ge) 可見光譜範圍內(nei) 的小型固態激光源已經徹底改變了流式細胞術,降低了現代儀(yi) 器對尺寸,成本和維護的需求。 這是科技發展中一個(ge) 令人鼓舞的趨勢,並將繼續為(wei) 更好的生物醫學分析儀(yi) 器做出貢獻。
參考文獻:1. W. G. Telford, Methods Cell Biol., 102, 375–410 (2011); doi:10.1016/b978-0-12-374912-3.00015-8.
2. P. K. Chattopadhyay et al., Cytometry A, 81, 456–466 (2012).
3. W. G. Telford, Cytometry A, 87, 1127–1137 (2015).
4. W. G. Telford, L. Strickland, and M. Koschorreck, Cytometry A, 91, 314–325 (2017).
翻譯/Nick
文章來源:LaserFocusWorld
轉載請注明出處。







 相關文章
相關文章
 熱門資訊
熱門資訊
 精彩導讀
精彩導讀


















 關注我們
關注我們

